
Prima della commercializzazione sul territorio europeo, ogni lotto di vaccino è sottoposto al Controllo di Stato che consiste in controlli analitici condivisi con le autorità competenti in materia di farmaci, eseguiti da uno dei laboratori della rete internazionale di laboratori ufficiali per il controllo dei medicinali (Official Medicines Control Laboratories, OMCL), indipendentemente dalla nazione in cui un singolo lotto di vaccino viene distribuito. Questi laboratori vengono identificati, validati e controllati dall’European Directorate for the Quality of Medicines and Healthcare (EDQM), un organo tecnico-scientifico del Consiglio d’Europa. Le analisi eseguite dagli OMCL per il Controllo di Stato sono specifiche per tipologia di vaccino e definite da linee guida.
A seguito del buon esito del doppio controllo effettuato dall’azienda produttrice e dall’OMCL, in Italia l’AIFA ratifica la certificazione di rilascio del lotto fornita dall’OMCL e autorizza la commercializzazione dello specifico lotto di vaccino sul territorio italiano. I lotti risultanti non conformi agli standard stabiliti non sono immessi sul mercato.
Successivamente alla loro commercializzazione, tutti i medicinali, inclusi i vaccini, vengono sottoposti annualmente a controlli analitici definiti di Post-Marketing, stabiliti secondo programmi stabiliti a livello europeo tra EMA, EDQM e la rete degli OMCL (Centrally Authorised Products – CAP Programme), ovvero gestiti a livello nazionale con un programma di controllo ad hoc (PCA) effettuato in accordo con l’ISS (OMCL per l’Italia). I saggi analitici sono volti a verificare la rispondenza alle specifiche di qualità che sono state autorizzate per il singolo medicinale/vaccino e/o riportate nelle monografie di Farmacopea Europea.
L’elenco dei laboratori europei che controllano i vaccini li trovate qui
https://ec.europa.eu/health/sites/health/files/files/pharmacos/news/gl981001_en.pdf
In questo elenco troviamo a pagina 14
Jean-Louis Robert Laboratoire National de Santé B.P. 1102 L – 1011 LUXEMBOURG
Dal curriculum del dr Robert vediamo che ha lavorato per la Merk, una delle più grandi multinazionale dei farmaci a livello mondiale.
Ci domandiamo se una persona che ha lavorato per una industria farmaceutica possa poi controllare i vaccini ed altri farmaci validandone la sicurezza efficacia etc. Siamo difronte ad un conflitto di interessi? Ovviamente sono dubbi e non certezze.
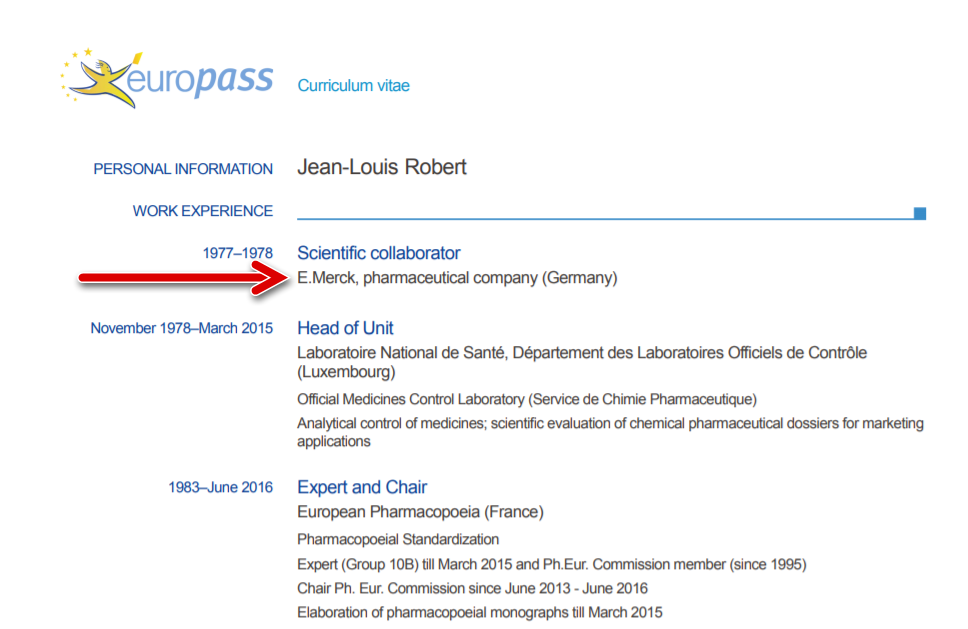
Curriculum dr. Robert
https://www.ema.europa.eu/sites/default/files/ContactsandExperts/jrobert_CV.pdf
Una biografia del dr. Robert la troviamo qui
https://www.who.int/medicines/services/expertcommittees/pharmprep/Robert-biography-2015.pdf?ua=1
Quindi ricapitolando le analisi di Corvelva sui vaccini sono per il Ministero della Salute incompleti e senza validità metodologica scientifica, mentre laboratori deputati al controllo dei vaccini sono guidati da autorevoli scienziati che hanno forse qualche conflitto di interesse?
Atto Camera
Interrogazione a risposta immediata in commissione 5-02795 presentato da CECCONI Andrea testo di Mercoledì 2 ottobre 2019, seduta n. 231
CECCONI e CUNIAL. — Al Ministro della salute. — Per sapere – premesso che:
il decreto-legge n. 73 del 2017 viene approvato definitivamente nella XVII legislatura il 28 luglio 2017;
nella stessa giornata in fase di discussione degli ordini del giorno si è discusso anche l’ordine del giorno 9/04595/002 dell’Onorevole Ivan Catalano, che è stato respinto;
in sede di esame del Doc. XXII, n. 80, veniva rilevato che vi erano delle criticità relative alle modalità di somministrazione dei vaccini relative al rischio intrinseco degli effetti autoimmuni, immunosoppressivi, di iperimmunizzazione e di ipersensibilità causati dai vaccini e dichiarati dalle stesse case farmaceutiche nei foglietti illustrativi;
in data 7 febbraio 2018 è stata pubblicata la relazione conclusiva dei lavori della Commissione parlamentare di inchiesta sui casi di morte e di gravi malattie che hanno colpito il personale italiano impiegato in missioni militari all’estero a causa dell’uranio impoverito e della dispersione nell’ambiente di nanoparticelle di minerali pesanti prodotte dalle esplosioni di materiale bellico e a eventuali interazioni, della passata legislatura, Doc. XII-bis n. 23;
a pagina 144 si legge: «La Commissione prende atto che, in data 14 gennaio 2018, sono pervenute dal vicepresidente Ivan Catalano osservazioni “in merito all’analisi dei componenti dei vaccini autorizzati per la profilassi vaccinale militare obbligatoria […]”. Data la rilevanza dei temi affrontati in queste osservazioni, ai fini di un’adeguata tutela della salute dei militari, la Commissione invita l’intera comunità scientifica, di cui l’ISS è parte, a prenderne conoscenza. La Commissione provvederà a trasmettere il predetto documento all’Istituto superiore di sanità per una indispensabile valutazione scientifica dei relativi contenuti. […]»;
la comunità scientifica si è mossa mediante le ricerche portate avanti dall’associazione Corvelva, i cui esiti sono stati presentati alla Camera dei deputati in due conferenze stampa, una del 24 gennaio 2019 e una del 27 giugno 2019 –:
quali iniziative il Governo abbia messo in campo, anche per il tramite dell’Istituto superiore di sanità, al fine di tutelare la salute dei militari, ma anche dei civili, date le analisi documentali effettuate dalla suddetta Commissione di inchiesta e pubblicate nella relazione di cui in premessa, al fine di ridurre il rischio di reazione avversa causata dalla somministrazione di farmaci contenenti componenti potenzialmente pericolosi.
(5-02795)
Risposta del governo ( Sileri )
Atto Camera
Risposta scritta pubblicata Giovedì 3 ottobre 2019
nell’allegato al bollettino in Commissione XII (Affari sociali)
5-02795
In via preliminare sulla base del supporto anche dell’Agenzia Italiana del Farmaco – AIFA, per quanto attiene ai profili sanitari della interrogazione, si rappresenta quanto segue.
Nell’Unione Europea i vaccini sono autorizzati in base ai requisiti di qualità, sicurezza ed efficacia definiti da linee guida europee e internazionali per tutti i medicinali con procedure comunitarie (che interessano l’EMA con il contributo di tutti gli stati membri) e nazionali che coinvolgono uno o più stati membri.
Come pubblicato sul portale istituzionale dell’AIFA, indipendentemente dal tipo di procedura autorizzativa, i controlli di qualità vengono effettuati dalla ditta durante tutto il ciclo produttivo di ogni lotto di vaccino, prima della distribuzione sul mercato, secondo gli standard previsti dalle autorità internazionali (Farmacopea Europea, Organizzazione Mondiale della Sanità – OMS, EMA, etc.) e nazionali. I metodi utilizzati per i controlli effettuati sui vaccini dalle aziende produttrici e le relative specifiche sono approvati dalle autorità competenti al termine della fase di valutazione del prodotto.
Inoltre, durante tutto il ciclo di vita del prodotto, gli effetti dell’utilizzo nei soggetti vaccinati vengono accuratamente monitorati mediante registrazione di ogni possibile reazione avversa, anche se solo apparentemente associata alla sua somministrazione. Pertanto, in base alle Direttive Comunitarie, tutti gli aspetti di qualità, efficacia e sicurezza, approvati nella fase autorizzativa, diventano legalmente vincolanti per l’azienda titolare dell’AIC.
L’aderenza a tutti i requisiti approvati viene periodicamente verificata dalle autorità competenti in tutte le fasi di sviluppo e produzione del vaccino attraverso i sistemi ispettivi, sia prima che dopo l’autorizzazione al commercio.
Inoltre, prima della commercializzazione sul territorio europeo, ogni lotto di vaccino è sottoposto al Controllo di Stato che consiste in controlli analitici condivisi con le autorità competenti in materia di farmaci, eseguiti da uno dei laboratori della rete internazionale di laboratori ufficiali per il controllo dei medicinali (Official Medicines Control Laboratories, OMCL), indipendentemente dalla nazione in cui un singolo lotto di vaccino viene distribuito. Questi laboratori vengono identificati, validati e controllati dall’European Directorate for the Quality of Medicines and Healthcare (EDQM), un organo tecnico-scientifico del Consiglio d’Europa. Le analisi eseguite dagli OMCL per il Controllo di Stato sono specifiche per tipologia di vaccino e definite da linee guida.
A seguito del buon esito del doppio controllo effettuato dall’azienda produttrice e dall’OMCL, in Italia l’AIFA ratifica la certificazione di rilascio del lotto fornita dall’OMCL e autorizza la commercializzazione dello specifico lotto di vaccino sul territorio italiano. I lotti risultanti non conformi agli standard stabiliti non sono immessi sul mercato.
Successivamente alla loro commercializzazione, tutti i medicinali, inclusi i vaccini, vengono sottoposti annualmente a controlli analitici definiti di Post-Marketing, stabiliti secondo programmi stabiliti a livello europeo tra EMA, EDQM e la rete degli OMCL (Centrally Authorised Products – CAP Programme), ovvero gestiti a livello nazionale con un programma di controllo ad hoc (PCA) effettuato in accordo con l’ISS (OMCL per l’Italia). I saggi analitici sono volti a verificare la rispondenza alle specifiche di qualità che sono state autorizzate per il singolo medicinale/vaccino e/o riportate nelle monografie di Farmacopea Europea.
Il monitoraggio della sicurezza viene effettuato attraverso le attività di farmacovigilanza (vaccinovigilanza) che hanno lo scopo di valutare in maniera continuativa tutte le informazioni relative all’uso sicuro e al rapporto beneficio/rischio dopo la loro immissione in commercio e per tutto il loro ciclo di vita con metodiche condivise a livello globale e ratificate da Direttive Europee.
Le attività di farmacovigilanza sono obbligatorie per legge sia per le autorità regolatorie (come AIFA ed EMA) sia per i titolari di autorizzazione all’immissione in commercio e si avvalgono di database delle reazioni avverse sia a livello nazionale (Rete Nazionale di Farmacovigilanza – RNF), che internazionali (EudraVigilance dell’EMA e VigiBase dell’Organizzazione Mondiale della Sanità).
Ogni sospetto rischio che emerga dalle attività di farmacovigilanza deve essere discusso a livello del Comitato per la Valutazione del Rischio in Farmacovigilanza dell’Agenzia Europea dei medicinali EMA (Pharmacovigilance Risk Assessment Committee o PRAC), a cui partecipano tutti gli stati membri.
Al fine di ottimizzare la vaccinovigilanza a livello nazionale, e di contribuire alle funzioni del PRAC è stato inoltre istituito dall’AIFA il Gruppo Di Lavoro sulla Vaccinovigilanza in collaborazione con i Centri regionali di Farmacovigilanza, i dipartimenti di Prevenzione regionali, il Ministero della Salute e l’ISS. Attraverso l’attività di tale gruppo, l’Agenzia è una delle poche autorità regolatorie al mondo che pubblica annualmente dal 2009 un rapporto sulla sorveglianza post-marketing dei vaccini.
È opportuno precisare che il Rapporto Vaccini 2019 recentemente pubblicato sul sito dell’Agenzia e tutti i rapporti precedenti non è stata confermata la presenza di rischi aggiuntivi a quelli già noti. Pertanto, il rapporto beneficio/rischio dei vaccini utilizzati resta immodificato.
Nell’ambito delle attività di monitoraggio dei vaccini, rientra l’esame della letteratura indicizzata e consolidata, relativa agli studi prodotti dalla comunità scientifica su qualità, efficacia e sicurezza di tali farmaci. Non risultano in tale ambito pubblicazioni, sia da fonti istituzionali che accademiche, relative alle problematiche sollevate dall’Associazione di genitori Corvelva, attraverso canali mediatici. Gli esiti delle attività della suddetta Associazione, per quanto inviati anche ad AIFA, sono mancanti di informazioni essenziali, soprattutto dal punto di vista metodologico, ai fini di una valutazione tecnico-scientifica, pertanto, nell’ambito dei compiti primari di tutela della salute pubblica, l’Agenzia ha richiesto e sollecitato la presentazione dei dati completi, requisito essenziale per la suddetta valutazione. I dati trasmessi nei mesi di luglio e agosto 2019 sono attualmente oggetto di approfondimento da parte di esperti anche dell’Istituto Superiore di sanità.
fonte
https://aic.camera.it/aic/scheda.html?numero=5-02795&ramo=C&leg=18
Fino a quando vi saranno conflitti di interesse in medicina non potremmo mai essere sicuri di un vaccino e/o farmaco.
E se vi è anche un solo dubbio un genitore ha tutto il sacrosanto diritto di poter scegliere se vaccinare o meno un figlio. Si alla libera scelta NO a qualsiasi obbligo vaccinale e a qualsiasi coercizione che possa ledere i diritti umani
















